Introduction
La sclérose en plaques (SEP) pédiatrique fait partie des maladies inflammatoires chroniques acquises du SNC de l’enfant et adolescent. Du point de vue physiopathologique se produit, suite à une atteinte de la barrière hémato-encéphalique, une invasion par des cellules inflammatoires et des cytokines, occasionnant des foyers inflammatoires locaux avec œdème et altération de la myéline1). Avec une incidence de 0.07-2.9/100’000 la SEP pédiatrique fait partie, contrairement à la forme adulte, des maladies rares2). D’autres différences marquantes par rapport à la SEP adulte sont la fréquence élevée de poussées et la tendance aux lésions sous-tentorielles au début de la maladie, provocant des déficits cognitifs précoces, une atrophie cérébrale ainsi qu’un handicap physique significatif à l’âge d’environ 35 ans chez les patients n’ayant pas bénéficié d’un traitement3). Pour la compréhension de la maladie il est essentiel que le processus inflammatoire chronique touche un cerveau encore en développement. Le potentiel de récupération particulièrement favorable lors des premières poussées est donc trompeur4). Pendant ces dernières années on a constaté que la SEP pédiatrique est tout sauf une variante bénigne et qu’une immunothérapie doit être entreprise dès que le diagnostic est assuré. Un diagnostic précoce, tenant compte des diagnostics différentiels, ainsi que le choix du médicament adéquat sont donc essentiels. Ce n’est que depuis une quinzaine d’années qu’on a véritablement pris conscience de la SEP de l’enfant et de l’adolescent, en supposant longtemps que la SEP pédiatrique avait une évolution plus bénigne. Manquent de ce fait des données importantes sur la fréquence, l’évolution sous traitement, la qualité de vie et les répercussions de la maladie sur le quotidien pendant l’enfance et l’adolescence. Cette lacune doit être comblée à l’aide d’un registre national (https://www.swiss-ped-ibraind.ch/).
Diagnostic de la SEP pédiatrique
Le diagnostic de la SEP pédiatrique se fonde également sur la mise en évidence d’une dissémination temporelle et spatiale, comme décrit dans les critères McDonald 2017 actuels5). Concrètement on entend par dissémination spatiale la mise en évidence de lésions démyélinisantes dans au moins deux régions définies (périventriculaire, (juxta)corticale, sous-tentorielle, médullaire). La dissémination temporelle est caractérisée par la présence simultanée à l’IRM de lésions prenant la substance de contraste et ne la prenant pas. Si cela n’est pas le cas lors de la première IRM, la présence de bandes oligoclonales dans le LCR ou d’une nouvelle lésion typique de SEP dans une IRM de suivi sont également des critères de dissémination temporelle. L’évolution de la SEP pédiatrique se caractérise par des poussées et des rémissions. Une poussée est définie par un nouveau trouble neurologique focal, durant au moins 24 heures. Pendant l’enfance et l’adolescence une détérioration insidieuse sans poussées clairement définies, comme on peut l’observer à l’âge adulte lors d’une SEP primaire progressive, laisse fortement suspecter une maladie génétique métabolique et non pas une SEP pédiatrique. Les premiers symptômes de la première poussée sont hétérogènes. Alors que chez l’adolescent est fréquente la névrite du nerf optique classique, chez l’enfant plus jeune dominent des atteintes neurologiques multifocales, avec des lésions étendues, mal délimités à l’IRM6). D’autres symptômes fréquents sont l’ataxie, les vertiges et des troubles oculomoteurs. La myélite transverse isolée n’est par contre un symptôme initial de la SEP pédiatrique que dans env. 13% des cas. Aucune cause claire ni marqueur biologique spécifique n’étant connus, le diagnostic de la SEP pédiatrique reste, après un examen clinique minutieux, l’imagerie et les analyses biologiques y compris ponction lombaire, un diagnostic d’exclusion. La connaissance de tout l’éventail des maladies inflammatoires du SNC de l’enfant et adolescent est donc indispensable au diagnostic de la SEP pédiatrique.
Diagnostic différentiel
En présence d’une atteinte neurologique focale associée à la mise en évidence de lésions de la substance blanche à l’IRM, le diagnostic est en général celui d’un premier événement démyélinisant aigu (EDA). Outre la SEP on évoquera en premier lieu une MOGAD, maladie associée aux anticorps anti-glycoprotéine de la myéline oligodendrocytaire (MOG) ou un trouble du spectre de la neuromyélite optique positive aux anticorps anti-aquaporine-4 (NMOSD-AQP4). La connaissance de la présentation clinique typique, des paramètres biologiques et des lésions IRM évocatrices (tabl. 1, fig. 1), ainsi que des symptômes mimant une SEP permet en général un diagnostic rapide. Pendant l’enfance les EDA sont, dans plus de la moitié des cas, des événements monophasiques ne nécessitant pas un traitement à long terme7).
Les symptômes des EDA dépendent de la localisation de la lésion. Pendant l’enfance il s’agit essentiellement de:
- névrites optiques avec diminution de l’acuité visuelle subaiguë et douleur bulbaire du côté atteint;
- myélite transverse avec symptômes paraplégiques et douleurs;
- lésions sous-tentorielles avec ataxie, troubles oculomoteurs, sensoriels ou moteurs;
- encéphalomyélite aiguë disséminée (EMAD) avec encéphalopathie et troubles neurologiques plurifocaux.
Maladie associée aux anticorps anti-MOG (MOGAD)
La glycoprotéine de la myéline oligodendrocytaire (MOG) est exprimée exclusivement par les oligodendrocytes du SNC8). Les anticorps anti-MOG ont été décrits d’abord chez des enfants avec une EMAD. Les données actuelles montrent qu’ils sont présents chez environ 30% des enfants avec un EDA, dans la plupart des cas transitoires, et associés généralement avec une maladie monophasique7). La clinique dépend de l’âge: alors que chez le jeune enfant l’EMAD domine, les enfants de >9 ans développent plus souvent un «phénotype optico-médullaire» avec névrite optique, myélite ou encéphalite du tronc cérébral. Les névrites optiques sont souvent bilatérales et généralement étendues, incluant la partie antérieure du nerf optique et la papille9). Le taux d’anticorps anti-MOG ne corrèle pas avec la gravité de la présentation clinique, par contre l’évolution du taux possiblement avec le risque de rechute. Un taux élevé d’anticorps anti-MOG exclut pratiquement une SEP. Il existe des cas avec des récidives multiples, se manifestant aussi encore après des années. L’issue est souvent favorable, les facteurs de risque pour des séquelles chroniques étant une présentation avec myélite transverse et probablement aussi un nombre élevé de rechutes10).
Trouble du spectre de la neuromyélite optique positive aux anticorps AQP4 (NMOSD-AQP4)
L’aquaporine-4 (AQP4), une protéine transmembranaire, est le canal à eau le plus fréquent du SNC. Elle est exprimée abondamment sur les astrocytes, sur les prolongements à la barrière hémato-céphalique. Le anticorps anti-AQP4 ont été mis en évidence d’abord chez des patients adultes avec une neuromyélite optique. Le NMOSD-AQP4 est rare pendant l’enfance, l’évolution souvent sévère avec des récidives dans 80% des cas11). La régression des symptômes après une poussée aiguë est souvent incomplète. Chez les enfants aussi il existe un risque élevé de séquelles entravant les activités quotidiennes, notamment une réduction de l’acuité visuelle suite à une névrite optique et des troubles de la fonction vésicale et rectale, éventuellement associés à une paraparésie spastique, due à une myélite transverse10). Est par ailleurs caractéristique pour le NMOSD-AQP4 l’implication de l’area postrema du tronc cérébral, se manifestant souvent par des vomissements et/ou hoquets incoercibles, ainsi que de structures diencéphaliques.

Images radiologiques mimant une SEP et «red flags»
Des lésions ressemblant à celles d’une SEP à l’IRM se retrouvent dans un grand nombre de maladies du SNC, p.ex. des vasculites, la sarcoïdose, certaines leucodystrophies et la lymphohistiocytose hémophagocytaire12). Des appréciations neuroradiologiques incorrectes ont par ailleurs été décrites dans certains cas de maladie de Fabry, une maladie de surcharge lysosomale qui peut occasionner une angiopathie des petits et gros vaisseaux avec des lésions de la substance blanche.
Les signes cliniques suivants sont atypiques d’une SEP pédiatrique: évolution lentement progressive, absence de récupération du moins après les premières poussées, apparition suraiguë de symptômes en quelques secondes/minutes (plutôt d’origine vasculaire), fièvre persistante et perte de poids, apparition de crises épileptiques, perte auditive/surdité, psychose.
Traitement de la SEP pédiatrique
Alors qu’on estimait longtemps que la SEP pédiatrique serait moins sévère qu’à l’âge adulte parce que les patients jeunes récupèrent mieux après des poussées, les résultats de recherche montrent le contraire. D’après les connaissances acquises ces dernières années, il n’y a aucune raison de priver de traitement les enfants et les adolescents avec une SEP. On distingue entre traitement d’une poussée et immunothérapie à long terme.
Traitement d’une poussée: l’objectif est de réduire la durée de la poussée et d’obtenir une récupération plus rapide des symptômes. Le traitement de la poussée en soi n’influence par contre pas le processus inflammatoire chronique sous-jacent qui évolue, souvent en arrière-plan, dans le SNC. La méthylprednisolone i.v. hautement dosée est le traitement de choix lors des poussées. La dose habituelle est de 20-30 mg/kg/jour pendant 3-5 jours. Si la récupération est insuffisante, on évaluera le changement pour un traitement de seconde ligne. Pour la SEP pédiatrique on peut soit répéter le traitement par méthylprednisolone 14 jour après la thérapie initiale ou changer pour la plasmaphérèse. La plasmaphérèse devrait être appliquée surtout en présence de troubles neurologiques sévères persistants ou de poussées foudroyantes.
Immunothérapie (traitement à long terme): l’objectif à moyen terme de l’immunothérapie est d’éviter les poussées et de nouvelles lésions cérébrales. Les médicaments contre la SEP nouvellement disponibles permettent d’atteindre cet objectif chez presque tous les patients pédiatriques avec une SEP. L’objectif à plus long terme consiste à éviter autant que possible des troubles cognitifs et l’atrophie cérébrale ou d’en stopper la progression. Dans quelle mesure cela est possible par les traitements actuellement disponibles, fait actuellement l’objet de recherches, les données à long terme faisant encore défaut. La différentiation préalable des MOGAD et NMSOD-AQP4 est essentielle, une détérioration pouvant intervenir dans ces maladies suite au traitement par certaines substances autorisées pour le traitement de la SEP.
Lors du traitement à long terme d’une SEP pédiatrique on distingue entre immunomodulation et immunosuppression (sélective). L’immunomodulation consiste p.ex. en une modification médicamenteuse de la relation entre Th1 et Th2, le patient n’étant toutefois pas immunosupprimé dans le sens classique. Cette forme de thérapie a l’avantage de pouvoir être maintenue sans risques pendant un temps prolongé. Le désavantage est l’efficacité souvent insuffisante («break-through disease») surtout tôt dans l’évolution de la maladie. En outre ces substances ne sont disponibles que sous forme injectable, ce qui n’est en soi pas optimal pendant l’enfance et l’adolescence. Les deux classes de substances (acétate de glatiramère und interférons) sont autorisées par Swissmedic pour le traitement de la SEP pédiatrique. L’autorisation se base sur les données de plusieurs études d’observation.
Par l’immunosuppression (sélective) on neutralise de manière ciblée certains compartiments du système immunitaire. Cela se fait par séquestration (fingolimod oral), blocage au niveau de la barrière hémato-encéphalique (administration iv mensuelle de natalizumab) ou élimination ciblée de certaines sous-populations (administration iv semestrielle d’anti-CD20). Ces formes de traitement sont plus puissantes mais comportent aussi plus de risques d’effets indésirables à long terme. En effet pendant les premières années la maladie ne se laisse souvent contrôler efficacement que par une thérapie immunosuppressive. Parmi ces classes de substances, seul le fingolimod est actuellement autorisé par Swissmedic en tant que traitement de premier choix, les autres préparations sont utilisées off-label si nécessaire et après une évaluation soigneuse des risques et bénéfices. L’autorisation du fingolimod, un modulateur des récepteurs de la sphingosine-1-phosphate, représente un jalon important dans le traitement de la SEP pédiatrique, étant la première substance dont l’efficacité et la tolérance ont été prouvées avec succès, dans le cadre d’une étude randomisée et contrôlée en double-dummy (étude PARADIGMS), chez des enfants et adolescents avec une SEP13). Pour le natalizumab, un inhibiteur de l’α4β1-intégrine, on sait d’après de grandes séries de cas qu’il est très efficace et bien toléré par les adolescents14). Des alternatives étant actuellement disponibles pour le traitement de SEP très actives, l’utilisation de natalizumab devrait être limitée aux patients virus JC-négatifs, avec standardisation et monitorage relatifs. Le rituximab, un anticorps monoclonal engendrant une déplétion transitoire de lymphocytes CD20+, offre l’avantage d’un dosage adapté au poids, ce qui permet son utilisation aussi chez des patients plus jeunes. Par ailleurs le rituximab n’est pas un inconnu en pédiatrie et n’est donc pas un «nouveau» médicament pour cette tranche d’âge. D’autres substances, autorisées pour le traitement de la SEP adulte, doivent être évaluées par des études pédiatriques.
Vu la complexité explicitée ci-dessus, dans la littérature scientifique internationale sont actuellement discutées deux approches thérapeutiques pour la SEP pédiatrique :
Start slow and escalate: cette approche thérapeutique débute habituellement par un immunomodulateur (interféron ou acétate de glatiramère), l’escalade vers un immunosuppresseur ne se faisant qu’en cas de réponse insuffisante. L’avantage de cette approche est que le traitement peut être poursuivi pendant des années sans risque d’effets indésirables sérieux. En réalité, seuls peu de patients réagissent de manière satisfaisante à ces médicaments, l’escalade thérapeutique étant souvent inévitable.
Start strong, maintain remission: cette approche thérapeutique tient compte de l’activité intense de la maladie, avec des troubles cognitifs et une atrophie cérébrale précoces. Cette stratégie a pour objectif de contrôler la maladie le plus rapidement possible. On introduit donc d’emblée un immunosuppresseur. Si la situation reste stable, on peut envisager une désescalade. Le contrôle rapide de l’activité de la maladie et le retour à la vie normale, ainsi que la bonne tolérance des médicaments sont des avantages, l’évaluation risque-bénéfice et le choix du moment de la désescalade étant les défis de cette approche.
Le choix entre ces deux approches thérapeutiques sera fait individuellement pour chaque patient. Les recommandations dépendent essentiellement de l’âge du patient, de l’activité et de la sévérité de la maladie lors du diagnostic, de la récupération après la première poussée et d’éventuelles maladies associées (rares chez l’enfant et l’adolescent). Un traitement efficace n’étant finalement possible à long terme qu’avec une prise de conscience de la nécessité du traitement par l’adolescent, le souhait du jeune patient doit être pris en considération lors du choix thérapeutique.
D’après les «natural history studies» on sait que le passage à la phase évolutive secondaire du jeune âge adulte dépend de l’activité initiale de la maladie3). Des études neuroradiologiques ont par ailleurs montré que la «normal appearing white matter» à l’IRM est tout sauf normale15). La conclusion «ne pas traiter n’est pas bien» est scientifiquement suffisamment prouvée. Le traitement immunomodulateur ou immunosuppresseur est donc recommandé pour tous les enfants et adolescents avec une SEP.
Résumé
La SEP est rare pendant l’enfance et l’adolescence et se présente cliniquement la plupart des fois par des troubles neurologiques focaux, associés à des images typiques à l’IRM du système nerveux central. Le diagnostic différentiel doit exclure en première ligne les affections cérébrales inflammatoires associées à des anticorps, comme les maladies MOGAD ou NMOSD; notamment chez l’enfant plus jeune on évoquera aussi des maladies métaboliques congénitales touchant la substance blanche. Pendant l’enfance et l’adolescence la SEP évolue par poussées et fait partie des maladies inflammatoires chroniques du SNC. On considère actuellement que l’activité inflammatoire chronique dans le cerveau encore en développement est la cause principale des troubles cognitifs précoces chez ces jeunes patients. Pour le traitement on dispose entre temps d’immunomodulateurs et immunosuppresseurs efficaces et bien tolérés. Le choix de la substance adéquate reste un choix individuel et sera fait par les spécialistes ayant suffisamment d’expérience avec le diagnostic et le traitement de cette maladie pendant l’enfance et l’adolescence.

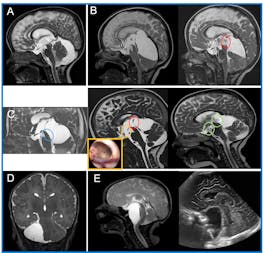
Figure 1. A-C: IRM cérébrale d’une adolescente de 15 ans avec sclérose en plaques. FLAIR (A,B): lésions périventriculaires disséminées (en «doigts de Dawson», étoile), juxta-corticales et infratentorielles, T1 (C): absorption du produit de contraste par certaines lésions. D-F: IRM d’une fillette de 5 ans avec EMAD. T2 (D), Flair (E): lésions corticales, sous-corticales et thalamiques mal délimitées, floues, T2 (F): myélite transverse, étendue. G: IRM d’une fille de 10 ans avec une névrite optique (T1 avec produit de contraste): tuméfaction et absorption du produit de contraste par le nerf optique à gauche.
Références
- Lucchinetti CF, Popescu BF, Bunyan RF, et al. Inflammatory cortical demyelination in early multiple sclerosis. N Engl J Med. 2011;365(23):2188-2197.
- Banwell B, Kennedy J, Sadovnick D, et al. Incidence of acquired demyelination of the CNS in Canadian children. Neurology. 2009;72(3):232-239.
- Renoux C, Vukusic S, Mikaeloff Y, et al. Natural history of multiple sclerosis with childhood onset. N Engl J Med. 2007;356(25):2603-2613.
- O’Mahony J, Marrie RA, Laporte A, et al. Recovery From Central Nervous System Acute Demyelination in Children. Pediatrics. 2015;136(1):e115-123.
- Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O. Multiple sclerosis. Lancet. 2018;391(10130):1622-1636.
- Waldman A, Ness J, Pohl D, et al. Pediatric multiple sclerosis: Clinical features and outcome. Neurology. 2016;87(9 Suppl 2):74-81.
- Waters P, Fadda G, Woodhall M, et al. Serial Anti-Myelin Oligodendrocyte Glycoprotein Antibody Analyses and Outcomes in Children With Demyelinating Syndromes. JAMA Neurol. 2020;77(1):82-93.
- Reindl M, Waters P. Myelin oligodendrocyte glycoprotein antibodies in neurological disease. Nat Rev Neurol. 2019;15(2):89-102.
- Wendel EM, Baumann M, Barisic N, et al. High association of MOG-IgG antibodies in children with bilateral optic neuritis. Eur J Paediatr Neurol. 2020;27:86-93.
- Bruijstens AL, Breu M, Wendel EM, et al. E.U. paediatric MOG consortium consensus: Part 4 – Outcome of paediatric myelin oligodendrocyte glycoprotein antibody-associated disorders. Eur J Paediatr Neurol. 2020;29:32-40.
- Fadda G, Armangue T, Hacohen Y, Chitnis T, Banwell B. Paediatric multiple sclerosis and antibody-associated demyelination: clinical, imaging, and biological considerations for diagnosis and care. Lancet Neurol. 2021;20(2):136-149.
- Chhabda S, Malik P, Reddy N, et al. Relapsing Demyelinating Syndromes in Children: A Practical Review of Neuroradiological Mimics. Front Neurol. 2020;11:627.
- Chitnis T, Arnold DL, Banwell B, et al. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis. N Engl J Med. 2018;379(11):1017-1027.
- Ghezzi A, Moiola L, Pozzilli C, et al. Natalizumab in the pediatric MS population: results of the Italian registry. BMC Neurol. 2015;15:174.
- Aubert-Broche B, Fonov V, Narayanan S, et al. Onset of multiple sclerosis before adulthood leads to failure of age-expected brain growth. Neurology. 2014;83(23):2140-2146.